阿尔茨海默症(AD)是最常见的神经退行性疾病之一,随着社会老龄化的加剧,其发病率逐年攀升且缺乏有效治疗药物,给患者和社会造成了巨大的痛苦和经济负担。近期我中心王杰菲团队围绕AD疾病,构建了一种具有活性氧(ROS)响应的近红外脑靶向聚集诱导发光(AIE)纳米诊疗剂用于AD诊疗。研究结果以“A one-two punch targeting reactive oxygen species and fibril for rescuing Alzheimer’s disease”为题发表在Nature Communications(中科院一区SCI-TOP期刊,IF = 16.6)。
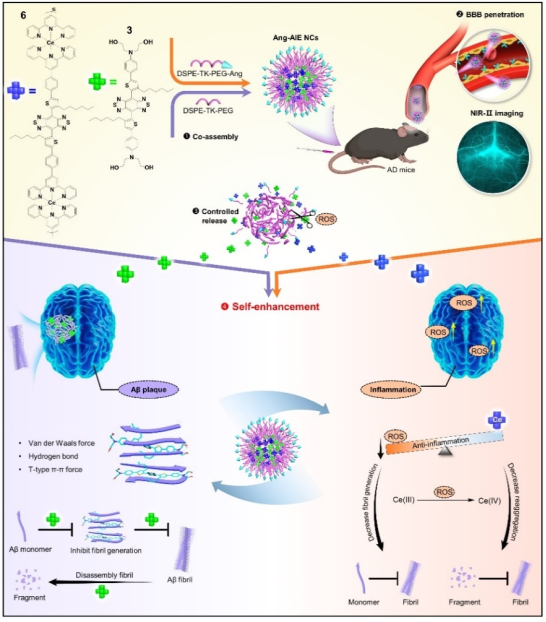
毒性β淀粉样蛋白(Aβ)和有害炎症是阿尔茨海默病的两个主要病理标志。但是目前基于Aβ检测和抑制的临床诊疗实验绝大部分以失败告终,一方面是由于血脑屏障(Blood brain barrier,BBB)的存在,多数分子无法穿越BBB入脑发挥成像和治疗作用;另一方面现有药物特异性差、作用靶点单一、缺少成像功能辅助体内研究,造成该疾病的预后较差、研究进展缓慢。针对上述挑战,该团队成功构建一种具有Aβ纤维降解和ROS调节的脑靶向近红外二区AIE纳米诊疗剂,用于AD的近红外实时成像和精准诊疗。
团队创新设计“双靶点—双功能组分治疗”的策略,首先采用Ce金属配合物方法,结合具有多转子、大共轭离域结构的近红外分子骨架,设计合成了一种Ce(III)-AIE分子(分子6),利用中心Ce金属的抗氧化能力,实现脑内炎症的有效缓解和脑内氧化还原水平的平衡,有效降低Aβ纤维的聚集进程。另一方面,合理设计具有二乙醇胺端基和多个疏水单元的AIE分子(分子3),实现对Aβ纤维高亲和结合力的同时,能有效解聚Aβ纤维并抑制解聚碎片的再次聚集,同时增强改善脑内的炎症水平。两者的有机结合和两种分子功能上的相互促进,形成一个自增强的循环,在AD模型小鼠上获得了良好的行为认知改善。该研究为“双一流”生物学科在脑科学前沿领域的发展做出重要推动作用。
我中心王杰菲副教授和博士研究生上官萍为共同第一作者,香港中文大学唐本忠院士、我中心冰洋教授和汪欣副教授、南方医科大学南方医院张静教授为共同通讯作者。该工作得到了河南大学双一流建设经费、国家自然科学基金、河南省科技研发联合培育基金、河南省高校科技创新人才计划的资助。
文章链接:https://www.nature.com/articles/s41467-024-44737-x
