日前,我中心在癌细胞膜与线粒体杂膜伪装Gboxin负载的仿生纳米药物用于GBM治疗方面取得最新进展,论文以:“Cancer cell-mitochondria hybrid membrane coated Gboxin loaded nanomedicines for glioblastoma treatment”为题发表在Nature Communications(中科院一区TOP期刊,IF=16.6)。
Gboxin是一种氧化磷酸化抑制剂,能够通过抑制F0F1ATP合酶复合物V的活性,从而特异性抑制GBM的生长。Gboxin具有极好的GBM细胞杀伤效果,其IC50为150 nM,仅为GBM临床一线化疗药物替莫唑胺的千分之一。然而,Gboxin的抗GBM效果和进一步临床应用受到血液循环差、血脑屏障(BBB)、非特异性GBM组织/细胞摄取以及GBM部位积累不足等限制。针对上述挑战,实验室构建了一种癌细胞-线粒体杂膜伪装的ROS响应型纳米颗粒用于靶向递送Gboxin,有效延长Gboxin的血液循环时间和提高其在肿瘤部位的积累,最终实现GBM高效治疗。
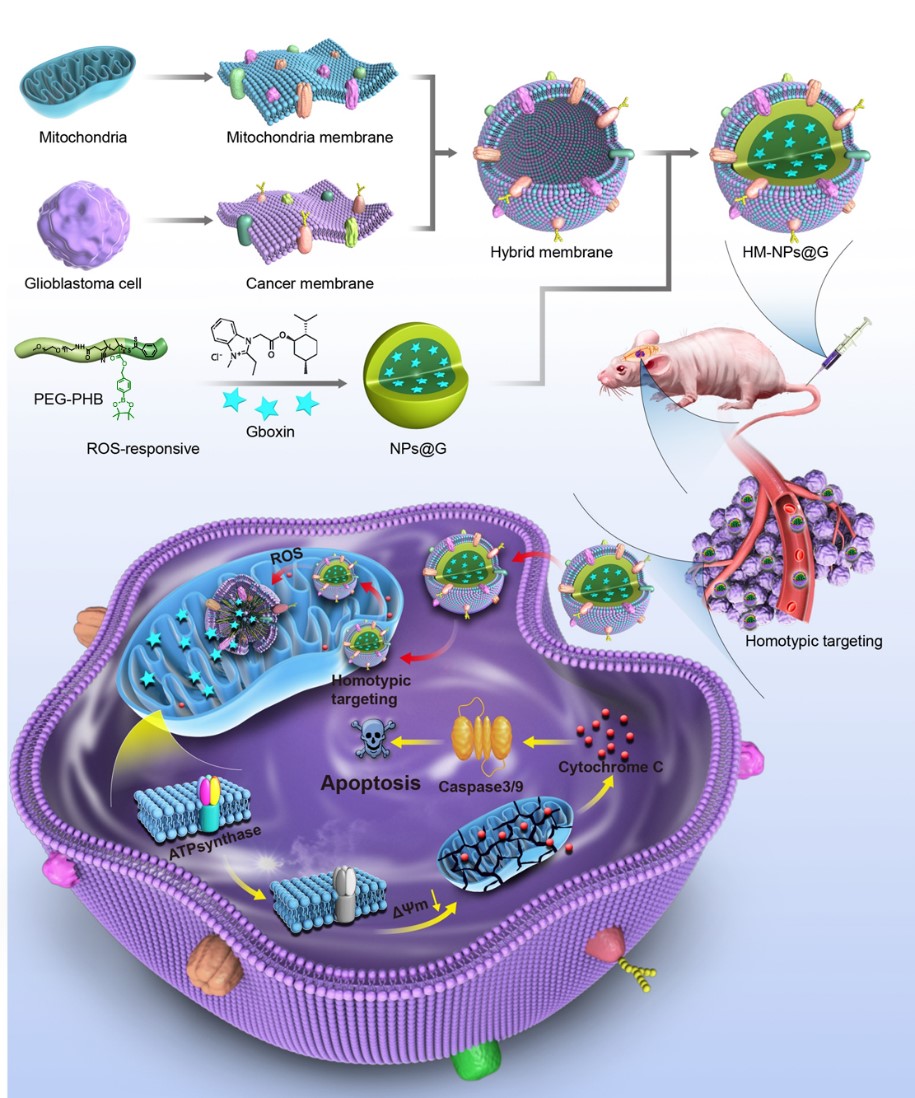
该仿生纳米药物以癌细胞-线粒体杂膜为外壳,以ROS响应型负载Gboxin的纳米颗粒为内核。杂膜伪装赋予该纳米药物独特的多重优势,包括良好的生物相容性、显著改善的Gboxin药代动力学、高效的BBB穿透以及GBM细胞和线粒体双重同源靶向。此外,ROS响应型纳米载体可以在GBM细胞线粒体内高水平ROS刺激下,快速响应释放出Gboxin。这一系列巧妙设计保证了Gboxin在GBM线粒体大量积累,并通过抑制ATP合酶激活凋亡通路,最终实现有效抑制肿瘤增长的目的。同时,该多功能纳米药物也减少了Gboxin对正常组织的毒副作用。由此可见,该杂膜仿生Gboxin纳米药物不仅提供了一种有效的平台用于GBM治疗,也为其它脑相关疾病的治疗或其它细胞器相关药物的精准递送提供了创新策略。
我中心邹艳教授和硕士研究生孙雅静为共同第一作者,冰洋教授为通讯作者。该工作得到了国家重点研发计划青年项目、国家自然科学基金和河南省高校科技创新人才计划的资助。该论文还得到了郑蒙教授、汪欣教授和杨慧清博士的大力支持。
